触媒とは
水素と酸素から水が生成する反応 H2 + 1/2 O2 → H2O を考えてみましょう。水素と酸素の混合ガスをガラス容器に入れ200℃に加熱しても何の反応も起こりません。しかし、混合ガスに少量の銅(Cu)を入れて加熱すると、水素と酸素は速やかに反応して水を生成します。反応後、加えた銅には何の変化も起こっていません。
このときCuがはたしている役割を図に示します。Cu → CuO → Cu のサイクルが1回転するたびに水が生成することになります。Cuは酸素と反応し消費され、生成したCuOは水素と反応しCuを再生します。サイクルを形成する2つの反応Cu + 1/2 O2 → CuO 、 CuO + H2 → H2O + Cu はいずれも速く進行します。H2O生成反応速度はCuあるいはCuOの存在で増大します。このような形式で進む反応を触媒反応と呼び、サイクルを形成し、消費・再生を繰返す物質を触媒と呼びます。
自然界でも触媒反応が見られます。フロンが成層圏に到達し、紫外線により分解し塩素原子(Cl)を生ずると、これも紫外線によって酸素分子が分解して生じた酸素原子(O)とともに、次の二つの反応 Cl + O3 → ClO + O2 、 ClO + O → O2 + Cl が起こり、全体として O3 + O → 2O2 の反応が進行し、オゾン層が破壊されます。Clはオゾン(O3)と反応して消費され、生成したClOはO と反応しO2 を生成するとともにClが再生されます。Cl(およびClO)が触媒として作用しています。
デンプンを分解するアミラーゼ、タンパク質を分解するペプシン、油脂を分解するリパーゼなど、我々の体内や他の生体内において化学反応を促進する酵素も触媒の働きをしています。
触媒は、固体、気体、液体のいずれの形態でもよく、作用中、自身は変化し続けますが、消費・再生を繰り返し、反応の前後で正味の増減はありません。触媒によって作り出される新しい経路を通って進む反応の活性化エネルギーは小さく、反応速度が大きいのです。
ある反応系に光を照射すると反応速度が著しく増大することがあります。また、多くの反応では熱を加えると反応速度が増大します。しかし、光、熱は物質ではないので触媒とは呼びません。ただし、光を照射すると性質が変化し、触媒作用を示すようになる二酸化チタン(TiO2)などの物質は光触媒と呼びます。
触媒には、反応速度を増大させるほかに、特定の物質だけと反応したり、特定の物質だけを生成する働きがあります。例えば、エチレン(C2H4)を触媒を使わないで酸素と反応させるには高温が必要で、生成物は二酸化炭素と水ですが、銀を触媒として用いると、より低温で主にエチレンオキシド(C2H4O)が生成します。また、エタノール(C2H5OH)を濃硫酸とともに加熱すると、硫酸が触媒として働き、エチレンと水が生成します。しかし、熱したCuにエタノールを触れさせると、エチレンは生成せずに、アセトアルデヒド(CH3CHO)と水素が生成します。また、酵素は、反応物(基質)の特定な立体構造を認識して反応を促進する触媒です。特定の物質だけと反応したり、特定の物質だけを生成する性質を選択性といい、選択性は触媒の種類によって異なります。適切な触媒を選ぶことによって、目的とする化合物を選択的に生成することができます。
反応速度を増加させ、望みの化合物を選択的に生成する特質を持っている触媒は、化学工業で広く用いられています。窒素と水素からアンモニアを生成する鉄触媒の発見によって、アンモニアが工業的に生産され、窒素肥料が大量に生産され、その結果農作物の生産量が飛躍的に増大し、世界の人口の急激な増加に伴う食糧問題の解決に多大な貢献をしました。ZieglerとNattaによるエチレン、プロピレンの立体規則的重合触媒の発明は、プラスチック工業を興し、以後の材料関連工業に大変化をもたらしました。原油から有機化学工業の原料となるナフサやガソリン、灯油などの液体燃料を製造したり、ナフサから各種の化学品や中間原料を生成するプロセスはもちろん、医薬、農薬を合成するプロセスに至るまで、ほとんど全ての化学プロセスにおいて、それぞれの反応に適した触媒が用いられています。
触媒は、化学品製造のためのみならず、環境負荷物質の低減のためにも広く用いられています。燃焼しても硫黄酸化物(SOx)を発生しない液体燃料をつくるため、石油中の硫黄成分を除去するのに硫化モリブデン(MoS)触媒が用いられています。自動車の排ガスに含まれている窒素酸化物(NOx)、一酸化炭素(CO)、未燃焼燃料を白金(Pt)、ロジウム(Rh)、パラジウム(Pd)などの貴金属触媒を用いて窒素(N2)、二酸化炭素(CO2)や水(H2O)に転換したり、工場や発電所の排煙中の窒素酸化物(NOx)をバナジウム(V)、タングステン(W)、チタン(Ti)からなる複合酸化物触媒を用いて除去しています。また、日用品においても、空気清浄機や建物の外壁などに光触媒作用をする二酸化チタン(TiO2)が、防汚、消臭、殺菌のために用いられています。魚焼き器や石油ストーブから発生する臭いを消すためにも触媒が使われています。このように、触媒は、化学工業だけではなく、化学反応が起こる場面では常に利用される可能性があります。
さて、Cuはなぜ水素と酸素から水の生成に触媒作用を示すのでしょうか、また、鉄(Fe)はなぜアンモニア合成の触媒になるのでしょうか。前者の場合にはCuは酸素分子(O2)を解離して酸素原子(O)を生成し、水素分子(H2)も解離して水素原子(H)を生成する能力があるからです。原子状の酸素、水素は分子状の酸素、水素に比べ反応性が高いのです。生成したOはCuと結合しCuOを形成し、CuOはHと反応して水を生成します。もしCuOがあまり安定すぎるならばHと反応することができず触媒のサイクルを形成できません。したがって、Cuでなくとも、水素分子と酸素分子を解離し、酸化物が安定すぎない金属も水生成の触媒となることができます。Cu以外でも、ほとんどの遷移金属は水生成の触媒として作用します。マグネシウム(Mg)など典型元素の金属の多くは、水素や酸素を解離できますが、(酸化マグネシウム)MgOなどの酸化物が安定すぎるので水素原子とも反応できず、触媒作用は示しません。
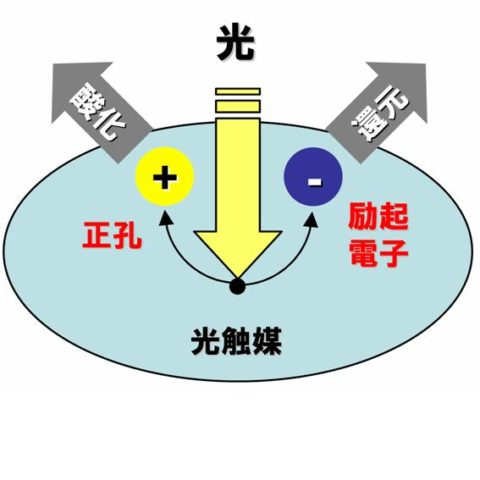
アンモニア合成の鉄(Fe)の触媒作用も、水素分子はもちろん、非常に強い結合を持つ窒素分子(N2)を解離して窒素原子(N)を生成することができるFeの化学的性質に因っています。Ziegler-Natta触媒は、オレフィンを活性化し重合する高い能力に加え、オレフィンの姿勢を制御できる性質があるために立体規則的な高分子の生成が可能になります。原油中の分子量の大きな炭化水素を分子量の小さい炭化水素に転換するために用いられるゼオライト触媒では、表面に存在するプロトン(H+)が炭化水素のC-C結合を切断することに作用します。酸化チタン(TiO2)の防汚、消臭、殺菌作用は、TiO2がが光を吸収することによって励起電子と正孔が生じ、これらがそれぞれ空気中の酸素を還元、さまざまな化学物質を酸化する働きをもつからです。
このように、反応の種類によって、それに適した触媒の性質も異なり、触媒の作用機構も多様です。
それでは、触媒の研究とはどのようなことをするのでしょうか。まず、触媒作用の解明、たとえば、どのように反応分子が活性化するのか、どのような経路を通って反応が進むのか、反応の中間体は何か、触媒のどのような性質が触媒作用を起こすのかを明らかにする研究があります。また、触媒の設計と調製、すなわち、目的とする反応を促進する触媒が具備すべき物理的・化学的性質を基にして、活性や選択性の高い触媒を探索することや、新しい触媒機能を持つ物質の創製を目的とする研究もあります。触媒学会は、これら研究の最新の結果を持ち寄り、討論し、新しいアイデアや情報を交換する場を提供しています。
光触媒
光を吸収して化学反応をおこす固体材料、これが光触媒です。反応の前後で光触媒は変化しないので「触媒」ということばが使われています。光触媒は、光のエネルギーによって光触媒の中に生じる励起電子と正孔が活性種としてはたらき、光触媒の表面にあるさまざまな化学物質に対して酸化還元反応をおこします。たとえば、水が電子と正孔により還元、酸化されると、それぞれ水素と酸素が生成します。この反応の原理は1970年代はじめに発見され、「本多-藤嶋効果(Honda-Fujishima Effect)」として知られています。水を酸素と水素に分解することは、光のエネルギーを化学のエネルギーに変換したことになります。
いっぽう、通常の空気中や水中で光触媒に光をあてると、空気に含まれる酸素が励起電子により還元されると同時に、いろいろな有機、無機の化合物が酸化されます。たとえば、室内の空気中にあるホルムアルデヒドなどの揮発性有機化合物(VOC)が正孔により二酸化炭素(CO2)にまで酸化される「無機化」がおこります。このように化学物質が分解除去される光触媒酸化反応は、さまざまな製品に応用されています。
[光触媒酸化反応の実例]
光触媒による色素(有機物質)の分解の様子。光触媒を塗布した板の上に、濃い青色の色素を塗り重ね、その上にガラス板(マスク)を置いて光を照射した。上の写真の上の方にある青い板が、色素を塗った板で、全体に青色が薄くなり、色素が光触媒作用によって酸化分解されたことを示している。用いたマスク(写真の下の方の透明な板)には黒いインクで「光」と書かれており、文字の部分だけは光が通らない。したがって、色素を塗った板上では「光」という文字の部分だけ元の色素の濃い青色が残っている。
このような酸化反応とならんで応用がすすめられているのが光誘起超親水化現象です。酸化チタンなどの光触媒をコーティングした表面に光を照射すると、水をかけても水滴ができず、うすい水の膜状にひろがるという表面の「超親水化」がおこり、光照射をやめてもしばらくその状態が持続します。これも光触媒反応の一種です。ビルの外壁やガラスを光触媒でコーティングすると、汚れがつきにくく、ついても雨水によって流れやすくなる「セルフクリーニング」効果が期待できます。
[光誘起超親水化の実例]
普通のガラスに水を垂らすと、ガラス表面はそんなに親水的でないので水がはじかれ、水は滴を作って流れ落ちる(写真右)。しかし、ガラス表面に光触媒を塗布し、光を照射すると表面が超親水性を持つので、水を垂らすと水は全面に膜状に広がる(写真左)。
酸化チタンは、安定、無毒無害であるため、もっともひろく利用されている光触媒ですが、光触媒反応をおこすためには紫外光(波長が約400ナノメートル以下)が必要です。太陽光や室内の照明にたくさんふくまれている可視光を利用するため、酸化チタンを加工したり、べつの種類の光触媒を開発したりするなどの研究がさかんに行われています。